- Imprimer
- Partager
- Partager sur Facebook
- Share on X
- Partager sur LinkedIn
Objectifs
De nombreux produits alimentaires se présentent sous forme de suspensions colloïdales dispersées dans une phase aqueuse. Les interactions entre ces colloïdes jouent un rôle clé dans le contrôle des propriétés rhéologiques et nutritionnelles des aliments. Parmi eux, les protéines occupent une place particulière, car leur conformation et leur réactivité sont fortement influencées par les conditions physico-chimiques, thermiques et mécaniques. Cette sensibilité complexifie les procédés de séparation, mais ouvre également de nouvelles perspectives pour l’assemblage des protéines alimentaires en ingrédients fonctionnels innovants. Notre approche expérimentale fortement basée sur le développement de procédés élémentaires couplés à des techniques avancées d’imagerie aux différentes échelles (microscopie, diffusion de rayonnement), nous a permis d’identifier les mécanismes rhéophysiques (i) limitant les procédés de séparation de suspensions de micelles de caséine et (ii) régissant l’assemblage des protéines laitières et végétales lors des procédés de mise en forme.
Résultats
Mécanismes d’accumulation et de relaxation de micelles de caséines lors de la filtration tangentielle du lait.
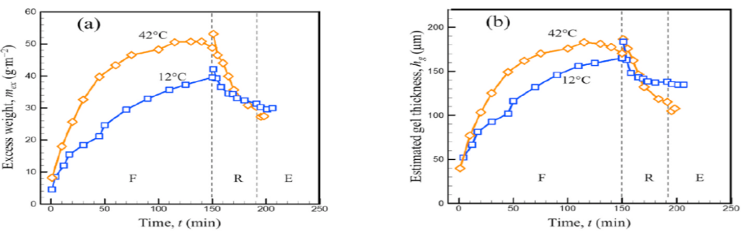
La micro et l’ultrafiltration sont des opérations de séparation très largement utilisées en industrie laitière mais elles restent mal maîtrisées, notamment du fait de la formation d’un dépôt concentré et gélifié de micelles de caséines au voisinage de la membrane. Notre objectif a été de comprendre les propriétés physiques, rhéologiques et cohésives des micelles de caséine accumulées à la surface de la membrane lors de la filtration tangentielle sous différentes conditions opératoires et plus particulièrement sous l’effet de la température (thèse de Floriane Doudiès, colla STLO / INRAE). L’étude du comportement rhéologique en fonction de la température a permis de montrer que les gels de micelles de caséine sont moins compressibles à froid (7 et 12 °C) qu’à plus hautes températures (20, 25 et 42 °C) et conduisent à une concentration de transition sol-gel plus faible et une cohésion entre micelles de caséine plus élevée. Ceci entraine que lorsque la température diminue, les dépôts gélifiés à la surface de la membrane sont plus épais et réduisent la performance de la filtration (Doudiès et al. 2019). Par une approche de SAXS in-situ, effectué au cours de la filtration, il a été montré qu’il est possible d’éliminer partiellement les dépôts formés durant les filtrations tangentielles et frontales, en relâchant la pression appliquée. Il a été mis en évidence que lors de la phase de relaxation et d’érosion induite par l’écoulement tangentiel, le dépôt gonflé obtenu à 42°C a été davantage érodé que celui obtenu à 12°C (Doudiès et al. 2021 ; Loginov et al. 2020, 2021). Ce qui met en évidence une plus grande performance de filtration à plus haute température, tout en amenant à la formation de dépôts de plus faible cohésion qui seraient alors plus facilement éliminés lors des opérations de nettoyage.
Aggrégation et gélification des protéines du lactosérum sous écoulement.
Co-produit des procédés de filtration du lait, l’isolat de protéines du lactosérum (WPI) est un mélange de sels minéraux et de deux protéines natives, la β-lactoglobuline, et l’α-lactalbumine. Ces deux protéines ont la particularité de se dénaturer à haute température (>80°C), avec pour conséquence de former des agrégats fractals dans des conditions de pH neutre. Cette structure fractale est particulièrement intéressante dans des applications de texturation des aliments. Les voies technologiques pour créer ces particules aux propriétés épaississantes étant principalement basées sur la modulation des conditions physico-chimiques lors de l’agrégation, l’objectif de notre recherche (thèse d’Alice Vilotte) a été d’identifier de nouvelles voies physiques d’agrégation et de gélification des WPIs dans le but de produire de nouvelles structures d'agrégats ou de gels.
Nous avons identifié les paramètres contrôlant les cinétiques de croissance des agrégats de WPI dans les procédés d’agrégation thermiquement activée (Vilotte et al., 2020). Pour cela, nous avons développé une approche de réduction d’échelle de l’agrégation en utilisant un microcapillaire chauffé à haute température (92 °C). Cette approche microfluidique permet d’éliminer les limitations dues aux transferts de chaleur. Nous avons couplé cette approche à une caractérisation structurale par diffusion statique des rayons X (ESRF, Grenoble). Les spectres de diffusion nous ont permis de suivre simultanément la croissance des agrégats à des échelles submicrométriques et la cinétique de dénaturation aux échelles des protéines. Cela nous a ainsi donné accès aux trois étapes clés du processus d’agrégation : la dénaturation, la nucléation et l’agrégation. Nous avons ainsi démontré que la taille et la masse des agrégats atteignent une valeur d’état stable en quelques secondes, bien que l’échelle de temps associée à la cinétique d’agrégation est de l’ordre de quelques minutes. De plus, nous avons observé que la cinétique de consommation des protéines natives était symétrique à celle des protéines agrégées, indiquant que l’agrégation se produit dès que les protéines sont dénaturées. Cela suggère que l’agrégation est limitée par une étape de nucléation et qu’il existe un mécanisme limitant la taille des agrégats, indépendamment du cisaillement induit par l’écoulement.
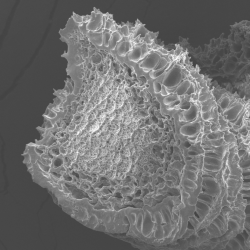
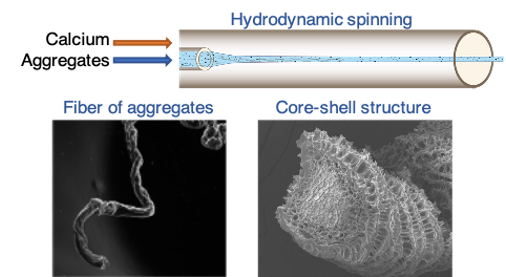
Ces agrégats de WPI ont ensuite été assemblés sous forme de fibres d’environ une centaine de micromètres de diamètre via un procédé microfluidique (Vilotte et al., 2022). Ce procédé consiste à co-injecter une suspension d’agrégats de WPI préformés avec une solution de chlorure de calcium, qui joue le rôle de réticulant entre les agrégats. Après avoir identifié les conditions hydrodynamiques relativement étroites permettant la formation de fibres, nous avons mis en évidence différents régimes de stabilité, qui varient de manière non monotone en fonction de la concentration en chlorure de calcium. À faible concentration en CaCl₂, les fibres ont tendance à se gonfler d’eau, jusqu’à atteindre une concentration critique de CaCl2 au-delà de laquelle elles se dispersent totalement, alors que leurs homologues à base de prtoéines végétales sont toujours stables (Vilotte et al., 2023). Ce mécanisme de micro-séparation de phase est cohérent avec un phénomène de synérèse. Plus surprenant, à haute concentration en CaCl₂, nous avons observé la formation de fibres stables présentant un gradient de concentration en protéines : la couronne des fibres est plus concentrée en protéines que leur intérieur. Ce résultat étonnant a motivé les travaux de post-doctorat d’Émilie Guilbert, visant à identifier les phénomènes physiques contrôlant ce dernier régime.
Pour cela, nous avons étudié le mécanisme de gélification ionique des agrégats de WPI par microscopie de fluorescence dans un système expérimental simple (Guilbert et al., 2024).
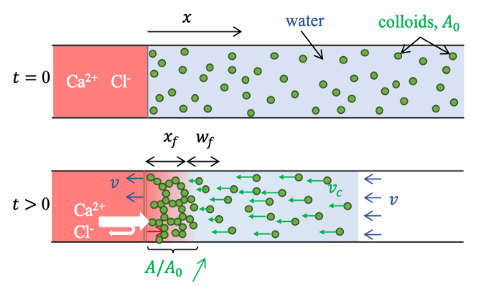
Celui-ci consiste en un capillaire en verre rempli de la suspension à gélifier, dont une des extrémités est mise en contact avec une goutte de CaCl₂. Grâce à ce dispositif, nous avons observé que le solvant de la suspension percole à travers le gel en formation vers la solution de CaCl₂. Ce flux, proportionnel à la pression osmotique de la solution de calcium, suggère une origine osmotique. Pour qu’un tel flux puisse s’établir, la présence d’une membrane partiellement sélective aux ions est nécessaire. En imposant une pression négative à la seconde extrémité du capillaire, nous avons pu moduler ce flux, jusqu’à l’annuler. En nous appuyant sur la relation de Kedem–Katchalsky, qui relie la différence de pression mécanique et osmotique au flux à travers une membrane, ainsi qu’à sa porosité et sa sélectivité, nous avons démontré que le gel en formation agit comme une membrane semi-perméable aux ions.
Nous avons également généralisé ce mécanisme à d’autres hydrogels obtenus par gélification ionique de polysaccharides, tels que l’alginate et la pectine. Une conséquence surprenante de cet effet, en lien avec la formation de fibres à gradient de concentration, est l’apparition de gradients de concentration à proximité de l’interface avec la solution gélifiante.
Propriétés viscoélastiques des protéines de graines d’haricot.
Nous avons étudié l’effet de la chaleur sur la cuisson des graines d’haricot afin d’optimiser les conditions de préparation des graines d’haricot. Le test mécanique simule le test d’écrasement au doigt des graines. Dans cette étude, la graine est assimilée à un système constitué d’eau, de protéine, d’amidon et en quantité résiduelle de matière grasse. C’est une approche qui permet de corréler les mécanismes de dénaturation des protéines, de gélatinisation de l’amidon et de transfert d’eau et de chaleur sur le comportement viscoélastique et mécanique mesurés (Teko et al., 2021).

L’étude a révélé un intervalle de temps de cuisson à 90 °C où les paramètres mécaniques (déformation) de cuisson sont quasi stables. La stabilité des paramètres de cuissons traduit un état antagoniste des effets de dénaturation protéique et de gélatinisation de l’amidon sur le comportement mécanique. Nous avons montré comment effet thermique affect le transfert d’eau du milieu de cuisson vers la graine. Le transfert d’eau influence le temps de cuisson et le comportement viscoélastique de la graine.
Références
Doudiès, F., Arsène, A. S., Garnier-Lambrouin, F., Famelart, M. H., Bouchoux, A., Pignon, F., & Gésan-Guiziou, G. (2019). Major role of voluminosity in the compressibility and sol–gel transition of casein micelle dispersions concentrated at 7 C and 20 C. Foods, 8(12), 652.
Doudiès, F., Loginov, M., Hengl, N., Karrouch, M., Leconte, N., Garnier-Lambrouin, F., ... & Gésan-Guiziou, G. (2021). Build-up and relaxation of membrane fouling deposits produced during crossflow ultrafiltration of casein micelle dispersions at 12° C and 42° C probed by in situ SAXS. Journal of Membrane Science, 618, 118700.
Loginov, M., Doudies, F., Hengl, N., Pignon, F., & Gésan-Guiziou, G. (2020). Influence of membrane resistance on swelling and removal of colloidal filter cake after filtration pressure release. Journal of Membrane Science, 595, 117498.
Vilotte, A., Bodiguel, H., Ako, K., Gunes, D. Z., Schmitt, C., & de Loubens, C. (2021). Kinetic and structural characterization of whey protein aggregation in a millifluidic continuous process. Food Hydrocolloids, 110, 106137.
Vilotte, A., de Loubens, C., Gunes, D. Z., Schmitt, C., & Bodiguel, H. (2022). Hydrodynamic spinning of protein fractal aggregates into core–shell fibers. ACS Applied Polymer Materials, 4(6), 4075-4080.
Vilotte, A., Bodiguel, H., Gunes, D. Z., Schmitt, C., Roux, D., Guilbert, E., ... & de Loubens, C. (2023). Formation and stability of fibers obtained by cold gelation of pea protein isolate aggregates in a hydrodynamic spinning process. Food Hydrocolloids, 145, 108999.
Guilbert, E., de Loubens, C., Vilotte, A., Schmitt, C., Gunes, D., & Bodiguel, H. (2024). Spontaneous Structuration of Biohydrogels by Membrane‐Free Osmosis. Advanced Functional Materials, 34(34), 2400888.
Teko, E., Osseyi, E., Munialo, C. D., & Ako, K. (2021). The transitioning feature between uncooked and cooked cowpea seeds studied by the mechanical compression test. Journal of Food Engineering, 292, 110368.
Personnels impliqués
K. Ako, H. Bodiguel, C. de Loubens, F. Pignon.
E. Guilbert (post-doc), A. Vilotte (PhD), T. Ekoué (PhD), F. Doudiès (PhD INRAE STLO - LRP)
Collaborations
- Imprimer
- Partager
- Partager sur Facebook
- Share on X
- Partager sur LinkedIn